Подпишитесь на наши группы в соц. сетях:
Подпишитесь на наши группы в соц. сетях: Вступая в группу, подписываясь на канал, оставляя комментарии, вы помогаете развивать сайт.
- Как читать гидравлические схемы
- Как читать электрические схемы
- Размеры трубной резьбы
- Принцип работы гидропривода
- Что такое класс точности манометра
- Расчет давления на глубине
- Расчет потерь напора по длине
- Расчет усилия гидроцилиндра
- Калькулятор для перевода давления
- Калькулятор для перевода расхода
- Как устроен пневмоцилиндр
- Как работает редукционный клапан
Уравнение состояния газа
При изучении термодинамических процессов, воздух считают идеальным газом, то есть таким газом, у которого молекулы бесконечно малы по объему, но имеют конечную массу, а силы взаимодействия между молекулами отсутствуют.
Состояние воздуха (и любого другого идеального газа), может быть охарактеризовано уравнением Менделеева-Клапейрона:
Это уравнение связывает основные физические величины, характеризующее состояние газа:
- р - давление
- V - объем
- Т - температура
- m - масса
Газовая постоянная R равна работе расширения, совершаемой 1 кг газа при нагревании его на 1 К при постоянном давлении.
При сжатии и расширении газа изменяются его характеристики. На основе уравнения состояния могут быть получены зависимости состояния газа (воздуха) при различных процессах, которые характеризуются разными условиями протекания. Рассмотрим каждый из возможных характерных процессов отдельно.
Изотермический процесс
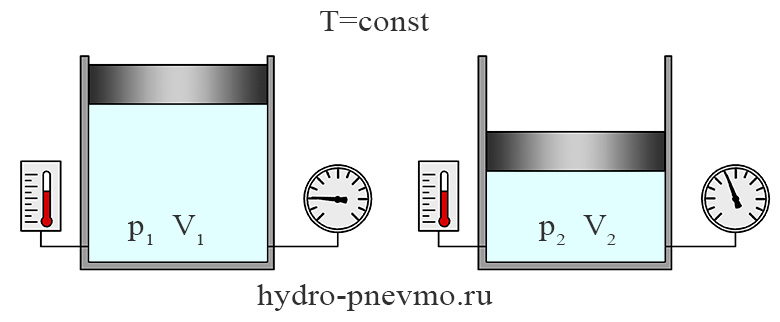
Изотермическим называют термодинамический процесс, протекающий при постоянной температуре. При Т1 = Т2, согласно закону Бойля-Мариотта, pV=const, поэтому при изотермическом процесс давление газа будет обратно пропорционально его объему.
Изобарный процесс
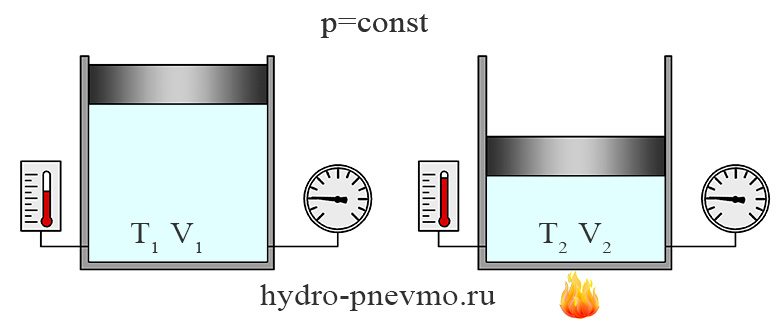
Изобарным называют термодинамический процесс, протекающий при постоянном давлении. При Т1 = Т2, отношение объема данной массы газы к температуре остается постоянным, то есть:
Изохорный процесс
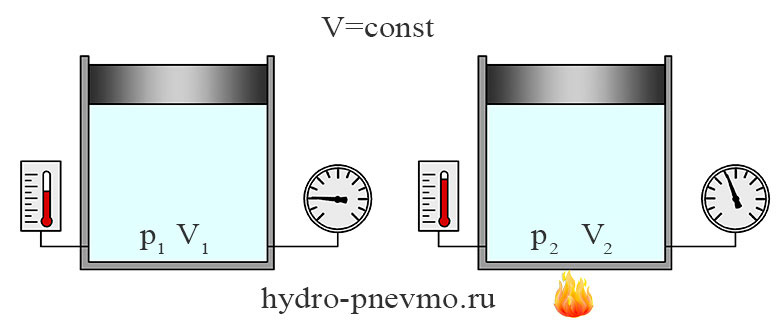
Изохорным называют процесс, протекающий при постоянном объеме. Если V1 = V2, то отношение давления к температуре также будет постоянным.
Адиабатический процесс
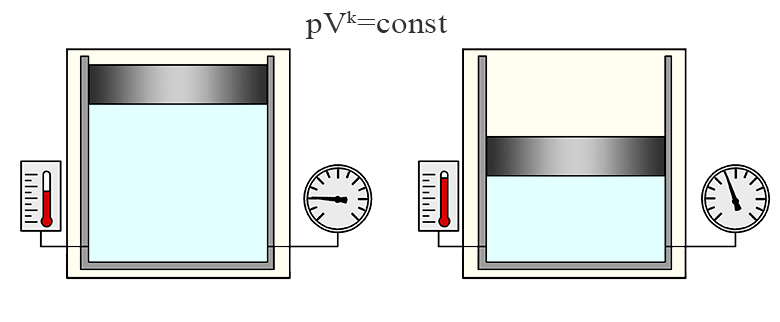
Адиабатическим или адиабатным называют такой процесс, при протекании которого теплообмен с окружающей средой отсутствует. Для такого процесса справедлива формула Пуассона:
Где k - показатель адиабаты k = cp/cv (для воздуха k=1,4). Зависимости между физическим величинами, характеризующими состояние газа при адиабатном процессе выглядят следующим образом:
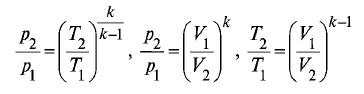
Политропный процесс
Политропным называют процесс, протекающий с теплообменом между газом и окружающей средой. Для этого процесса справедливо уравнение политропы:
Где n - показатель политропы n = (cp - c)/(v - c), для расчета пневмоприводов n выбирают из диапазона 1,25...1,35.
Зависимости между основными параметрами газа при политропном процессе выглядят следующим образом:
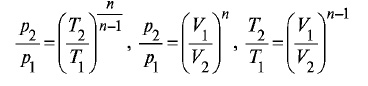
В общем случае, процессы протекающие в пневматическом приводе следует считать политропными.
На практике медленно текущие процессы, с некоторыми допущениями, можно считать изотермическими, быстротекущие процессы адиабатными.
О файлах cookie на этом веб-сайте
Мы используем сервисы Яндекс Метрика и Рекламная Сеть Яндекс, которые могут применять файлы cookie, собирать статистику посещения сайта. Продолжая просмотр сайта, вы соглашаетесь с использованием выше указанных сервисов в соответствии с «Политикой конфиденциальности»